肿瘤环境组织对肿瘤的影响已经被发现了很多年。在1976年,为了探索环境对肿瘤生长的影响,研究人员用致癌物质引起大鼠的基因突变。然后,它们被给予药物来抑制正常肝细胞的生长,并且为了刺激生长,大鼠的一部分肝脏被移除了。在这些条件下,唯一能够生长的细胞(例如癌细胞)都有基因突变,这种突变使它们能避开药物抑制生长效果。在被给予致癌物质,但没有生长抑制剂的大鼠中未观察到肿瘤的发展。该实验表明,当周围的组织正常时肿瘤不能生长;换而言之,从一个变异细胞发展而来的癌症只可能在基质细胞被改变(允许肿瘤细胞无限生长)的情况下发生。1
你可以在大多数生物教科书中找到与本章内容相关的信息,比如第十一版的《Campbell Biology》就是很好的选择。2
以下是本章内容的列表:
肿瘤内部情况
肿瘤的结构十分复杂,它包含了许多不同种类的细胞。过去,科学家专注于研究正常细胞如何转变到到肿瘤或癌症细胞,他们忽略了存在于肿瘤中的其他细胞。然而,在过去的几年内,很多证据表明肿瘤的其它部分,包括固有的非癌细胞(成纤维细胞,内皮细胞),结缔组织,和细胞外基质(ECM; 即提供结构支撑组织的成分,如胶原蛋白)都是在肿瘤形成(早期发育)和进展同样重要。这些成分共同被称为细胞基质。许多研究人员更喜欢更广义地称它们为肿瘤微环境(而不是细胞基质),因为它包含了免疫系统细胞(巨噬细胞,淋巴细胞)及非细胞分子(生长因子,蛋白酶),和或多或少的永久基质成分3 。由于肿瘤环境对癌症的作用被更好的理解,研究人员有可能研制出同时针对癌细胞和它们周围环境的新的治疗剂。同时针对癌症细胞和基质成分的药物可能比那些只打击癌症细胞的药物有效许多。
肿瘤微环境的组件可以分为四类:(1)肿瘤细胞,(2)非癌细胞,(3)分泌的可溶性因子,(4)和非细胞的固体材料如细胞外基质(ECM)4。肿瘤微环境的实际成分在患者和同一癌症的不同区域之间有很大的差异。肿瘤微环境经常随着病情的发展而变化,甚至连肿瘤中癌症细胞的百分比都可能改变5。
肿瘤及其周围环境的沟通是非常重要的。其相互作用既能促进也能抑制肿瘤生长发展。例如,转化生长因子β(TGF-Β)是肿瘤进展的关键调节剂。TGF-Β是细胞生长的强效抑制剂,并且能由癌症微环境中的多种细胞分泌;然而,许多晚期肿瘤中的基因突变导致癌细胞不受TGF-Β影响(意味着它们即使是在TGF-Β的存在的情况下仍然继续生长)。此外,肿瘤本身也分泌TGF-Β来抑制周围正常细胞的生长,从而使肿瘤细胞不与周围细胞竞争的情况下快速生长3 。通过这种方法,肿瘤在消耗周围细胞的情况下继续生长。
肿瘤微环境内的条件与正常组织相当不同,主要的变化有:
- 缺氧(低氧水平)
- 低pH值(酸性条件)
- 低葡萄糖水平
此外,大量的细胞死亡导致蛋白质和其他分子被释放到周围环境中。这些因素可能辅助或抑制肿瘤生长3。 缺氧导致了氧自由基的产生,氧自由基从而导致DNA损伤(突变)。修复该损伤的机制在低氧条件下的工作效率很低。最终的结果是肿瘤内的突变率的增加和更大的区域差异。另一个结果是,只有那些变异的细胞能在恶劣的条件下继续生存,并促进肿瘤生长6。
重要的是,肿瘤微环境内的情况不仅仅影响癌细胞。肿瘤周围的细胞表现出与正常细胞不同的特性。 这些细胞也会发生突变,并且与正常的组织相比更杂乱无章5。这些异常特性可能以两种方式可能产生。肿瘤微环境(低氧和低pH)的情况可诱导基因突变,或肿瘤释放可溶的产物(生长因子,细胞因子)引起基质细胞的突变3。 有趣的是,从乳腺癌患者处收集的非癌组织的基质细胞也存在基因突变,这表明在基质细胞中预先存在的基因变异为肿瘤产生提供了基础6。 许多实验已经表明了基质在肿瘤发展的重要性。
炎症细胞和癌症
免疫系统对癌症的作用是双刃剑。虽然有证据表明强大的免疫系统可能是有益的,但在许多情况下免疫系统明显促进了肿瘤生长7。例如,免疫系统较弱(免疫抑制)的患者具有较高的癌症发病率,但另一方面,先天免疫细胞被认为通过释放调节细胞生长,迁移,以及血管生成的分子而有助于肿瘤形成8。先天免疫细胞,例如不产生抗体但能够吞噬外来生物体的巨噬细胞,在恶化前和恶性组织中有显著效果。此外,许多癌症(胃,子宫颈,结肠,肝)与感染相关,并与正常宿主免疫反应活动相关。慢性炎症使人更容易得某些癌症;例如,患有克罗恩病的患者具有较高的结肠直肠癌发病率。对炎症是如何导致癌症更好的理解可能带来新的有效癌症治疗方法7。
在另一种情况下,肿瘤本身吸引免疫细胞,而免疫细胞可以影响肿瘤进展。 肿瘤细胞损伤和缺氧环境将巨噬细胞从血液吸引到肿瘤周围的组织中。 在大多数情况下,与肿瘤高度相关巨噬细胞(TAM)计数与低存活率相关。 许多肿瘤分泌因子能阻止巨噬细胞警告其它免疫细胞癌细胞的存在,导致免疫系统不能识别肿瘤。 巨噬细胞本身也分泌增强肿瘤细胞增殖,侵入和促进血管生成的因子。 此外,与肿瘤高度相关巨噬细胞(TAM)释放氧自由基和其他可能在周围细胞中制造基因突变的致癌物质。 与肿瘤高度相关巨噬细胞(TAM)能够粘附于肿瘤细胞的能力使得巨噬细胞将肿瘤细胞携带到循环中,从而有助于癌症的扩散(转移)。9, 6, 8
了解更多关于炎症和癌症的信息。
了解更多关于免疫系统的信息。
成纤维细胞和癌症
成纤维细胞是基质中的主要细胞。 它们负责产生细胞外基质(ECM)以及结缔组织。 因为不同的组织具有不同的需求,来自不同器官的成纤维细胞表达的基因也不同。 成纤维细胞行为的变化与肿瘤进展相关,主要是由于肿瘤产生的因子。 成纤维细胞开始表达α-SMA(α-平滑肌肌动蛋白),这允许它们收缩。 这些肌成纤维细胞能快速复制,并被密集网状的结构蛋白胶原的包围。 这被称为结缔组织形成,并且通常与免疫细胞的聚集和血管生成相关10, 8。
有趣的是,尽管成纤维细胞的行为(表现型)经常由于接近肿瘤而改变,但在其他情况下,变异的成纤维细胞也被从未患癌症但遗传性易感的患者身上分离出来。 这一观察表明这些改变的成纤维细胞可能真的有助于癌症的发展11。
在没有肿瘤的情况下,这些细胞如何变得致癌的呢? 存在几种可能性,包括暴露于致癌物质,由老化累积的基因损伤,和激素失衡。存在于愈合伤口中的分子也可以改变成纤维细胞,使得它们类似于在肿瘤附近发现的成纤维细胞。8
外来体
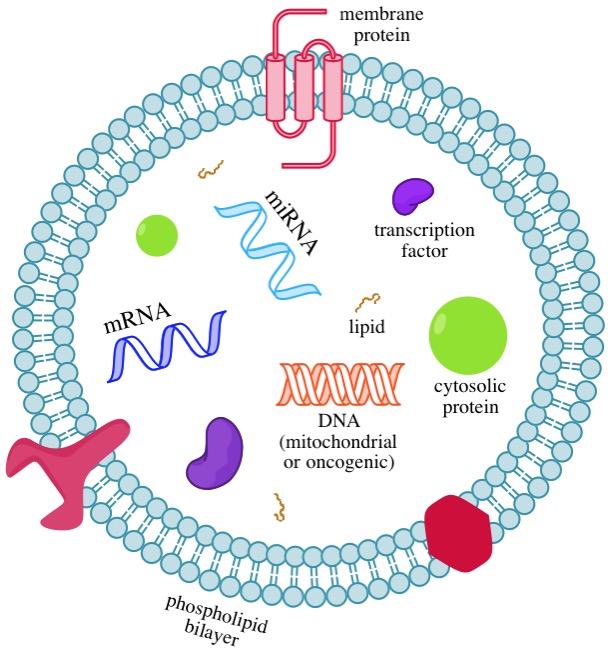
外来体是微小的,细胞外的囊泡(它们测量直径约30-100纳米),它们可从一个细胞携带的蛋白质,脂质,miRNA,mRNA,和DNA到另一细胞12。通过在两个地点间传递这些分子,外来体实现了细胞间交流的功能12,并且它们可以调节许多生理和病理过程13。它们被从细胞表面释放,在血液,尿液,唾液,乳汁,和其它体液中找到14。当一个外来体与受体细胞融合,其分子货物能够进入细胞并改变基因表达15。

基质金属蛋白酶和癌症
成纤维细胞在正常组织和癌变组织中执行的最关键的作用之一就是产生和重塑细胞外基质(ECM)。ECM不仅为组织提供结构支持和强度保障,它还为细胞表面的受体提供附着位点,并且作为细胞因子和其它生长因子的储存库24。与肿瘤相关的ECM的结构是异常的,具有松散的结构和无组织的胶原纤维25 。基质金属蛋白酶(MMP)一个很大的酶的家族,它们能够降解ECM成分,并且在维持ECM中起到关键的作用。 ECM的降解释放生长因子,增强迁移,并改变细胞间和细胞与ECM的相互作用26。虽然MMP可以由肿瘤细胞产生,但大多数是由成纤维细胞和巨噬细胞产生的,并且在肿瘤与基质的交接面含量很高5。因为MMP是通过这些细胞分泌到周围环境中的,所以它们是肿瘤与其环境之间发生的相互作用的很好的例子。
证据表明MMP是肿瘤发展的多个步骤中的关键参与者; 它们促进转移,血管生成,甚至肿瘤的形成。 关于MMP活动的许多悖论之一是MMP常常具有截然相反的作用。这取决于肿瘤环境的成分和出现的MMP的性质。 例如,MMP可以促进或抑制血管生成,这取决于它们从细胞外基质(ECM)释放的分子27, 26。 由于它们对肿瘤形成和转移的强效作用,一些临床试验尝试使用MMP抑制剂作为抗癌治疗方法。然而,这些试验很快就停止了,因为患者出现肌肉和骨骼疼痛,形成结缔组织结节,并发展为关节疾病。 这些试验强调了对于这些对多种组织功能都有重要作用的分子,要找出靶向治疗方法是十分困难的。27
总结:肿瘤和宿主细胞的相互作用
肿瘤微环境
- 肿瘤的微环境由四部分组成:
- 癌细胞
- 非癌细胞
- 分泌可溶性因子
- 非细胞,固体物质
- 肿瘤微环境的真是成分是高度可变的。
肿瘤微环境内部情况
- 低氧水平(缺氧),酸性环境(低pH)和低糖(葡萄糖)水平在肿瘤中是很常见的。
- 肿瘤微环境内的情况既影响癌症细胞也影响正常的细胞。
- 肿瘤周围的组织通常也是杂乱无章的。
炎症细胞和癌症
- 免疫系统可能促进或者抑制肿瘤生长。
- 许多癌症都和慢性炎症有关,慢性炎症会激活先天免疫系统细胞。
- 巨噬细胞分泌的因子可以促进肿瘤细胞分裂,入侵和血管形成。
成纤维细胞和癌症
- 成纤维细胞是细胞基质的主要成分。
- 成纤维细胞行为的改变与肿瘤发展有关。
- 成纤维细胞产生的间质金属蛋白酶(MMPs)降解细胞外基质。
- MMPs是癌症产生,转移和血管形成的关键因素。
外来体和癌症
- 外来体由癌症细胞或其他细胞分泌的被膜包裹的小囊泡
- 外来体携带蛋白质和核酸
- 当外来体被运输到远处的身体部位时,它们可以改变免疫反应和/或增强癌症的传播
基质金属蛋白酶和肿瘤微环境
肿瘤基质和转移
- 种子和土壤假说:特定的肿瘤细胞(种子)只能占据特定的具有合适生长环境的远处组织(土壤)
- 特异性转移的发生有两个必要条件:1)形成合适的着陆点,和2)肿瘤细胞中特定基因的表达。
- 肿瘤细胞可能侵入新的组织,但不“占领”它。 其原因目前还未知的。 这些细胞被认为是“休眠”癌细胞。
- 1 Solt D., Farber E. A new principle for the analysis of chemical carcinogenesis. Nature. 263:701-703. 1976.
- 2 Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Campbell Biology (11th ed.). Pearson.
- 3abcd Witz, I.P., and O. Levy-Nissenbaum. 2006. The tumor microenvironment in the post-PAGET era. Cancer Lett. 242:1-10. [PUBMED]
- 4 Cretu, A., and P.C. Brooks. 2007. Impact of the non-cellular tumor microenvironment on metastasis: potential therapeutic and imaging opportunities. J Cell Physiol. 213:391-402. [PUBMED]
- 5abc Zalatnai, A. 2006. Molecular aspects of stromal-parenchymal interactions in malignant neoplasms. Curr Mol Med. 6:685-93. [PUBMED]
- 6abc Laconi, E. 2007. The evolving concept of tumor microenvironments. Bioessays. 29:738-44. [PUBMED]
- 7ab Kopfstein, L., and G. Christofori. 2006. Metastasis: cell-autonomous mechanisms versus contributions by the tumor microenvironment. Cell Mol Life Sci. 63:449-68. [PUBMED]
- 8abcd Tlsty, T.D., and L.M. Coussens. 2006. Tumor stroma and regulation of cancer development. Annu Rev Pathol. 1:119-50. [PUBMED]
- 9 Condeelis, J., and J.W. Pollard. 2006. Macrophages: obligate partners for tumor cell migration, invasion, and metastasis. Cell. 124:263-6. [PUBMED]
- 10 Beacham, D.A., and E. Cukierman. 2005. Stromagenesis: the changing face of fibroblastic microenvironments during tumor progression. Semin Cancer Biol. 15:329-41. [PUBMED]
- 11 Schor, S.L., J.A. Haggie, P. Durning, A. Howell, L. Smith, R.A. Sellwood, and D. Crowther. 1986. Occurrence of a fetal fibroblast phenotype in familial breast cancer. Int J Cancer. 37:831-6. [PUBMED]
- 12ab Zhang, Xuan, Zenglin Pei, Jinyun Chen, Chunxia Ji, Jianqing Xu, Xiaoyan Zhang, and Jin Wang. "Exosomes for Immunoregulation and Therapeutic Intervention in Cancer." J. Cancer Journal of Cancer 7.9 (2016): 1081-087. [http://www.ncbi.nlm.nih.gov/pubmed/27326251] [PUBMED]
- 13abcde Zhou, Jianbiao, Sam Wang, Kangyun Sun, and Wee-Joo Chng. "The Emerging Roles of Exosomes in Leukemogeneis." Oncotarget (2015) [http://www.ncbi.nlm.nih.gov/pubmed/27191983] [PUBMED]
- 14abcde Isola, Allison L., and Suzie Chen. ¿Exosomes: The Link between GPCR Activation and Metastatic Potential?¿ Frontiers in Genetics 7 (2016): 56. PMC. [http://www.ncbi.nlm.nih.gov/pubmed/27092178] [PUBMED]
- 15 Raposo, Graça, and Willem Stoorvogel. "Extracellular Vesicles: Exosomes, Microvesicles, and Friends." J Cell Biol The Journal of Cell Biology 200.4 (2013): 373-83. [http://www.ncbi.nlm.nih.gov/pubmed/23420871] [PUBMED]
- 16 Zhang, Jian et al. ¿Exosome and Exosomal MicroRNA: Trafficking, Sorting, and Function.¿ Genomics, Proteomics & Bioinformatics 13.1 (2015): 17¿24. PMC. [http://www.ncbi.nlm.nih.gov/pubmed/25724326] [PUBMED]
- 17abc Tickner, Jacob A. et al. ¿Functions and Therapeutic Roles of Exosomes in Cancer.¿ Frontiers in Oncology 4 (2014): 127. PMC. [http://www.ncbi.nlm.nih.gov/pubmed/24904836] [PUBMED]
- 18 Bockhorn, Maximilian, Rakesh K Jain, and Lance L Munn. ¿Active versus Passive Mechanisms in Metastasis: Do Cancer Cells Crawl into Vessels, or Are They Pushed?¿ The lancet oncology 8.5 (2007): 444¿448. PMC. [http://www.ncbi.nlm.nih.gov/pubmed/17466902] [PUBMED]
- 19 Peinado, Héctor et al. ¿Melanoma Exosomes Educate Bone Marrow Progenitor Cells toward a pro-Metastatic Phenotype through MET.¿ Nature medicine 18.6 (2012): 883¿891. PMC. [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3645291/] [PUBMED]
- 20ab Tran, Thanh-Huyen, George Mattheolabakis, Hibah Aldawsari, and Mansoor Amiji. "Exosomes as Nanocarriers for Immunotherapy of Cancer and Inflammatory Diseases." Clinical Immunology 160.1 (2015): 46-58. [http://www.ncbi.nlm.nih.gov/pubmed/25842185] [PUBMED]
- 21 Johnsen, Kasper Bendix, Johann Mar Gudbergsson, Martin Najbjerg Skov, Linda Pilgaard, Torben Moos, and Meg Duroux. "A Comprehensive Overview of Exosomes as Drug Delivery Vehicles ¿ Endogenous Nanocarriers for Targeted Cancer Therapy." Biochimica Et Biophysica Acta (BBA) - Reviews on Cancer 1846.1 (2014): 75-87. [http://www.ncbi.nlm.nih.gov/pubmed/24747178] [PUBMED]
- 22 Romagnoli, Graziela Gorete et al. ¿Dendritic Cell-Derived Exosomes May Be a Tool for Cancer Immunotherapy by Converting Tumor Cells into Immunogenic Targets.¿ Frontiers in Immunology 5 (2014): 692. PMC. [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4298225/]
- 23 Mahaweni, Niken M. et al. ¿Tumour-Derived Exosomes as Antigen Delivery Carriers in Dendritic Cell-Based Immunotherapy for Malignant Mesothelioma.¿ Journal of Extracellular Vesicles 2 (2013): 10.3402/jev.v2i0.22492. PMC. [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3823268/]
- 24 Badylak, S.F. 2002. The extracellular matrix as a scaffold for tissue reconstruction. Semin Cell Dev Biol. 13:377-83. [PUBMED]
- 25 Sivridis, E., A. Giatromanolaki, and M.I. Koukourakis. 2004. "Stromatogenesis" and tumor progression. Int J Surg Pathol. 12:1-9. [PUBMED]
- 26ab Jodele, S., L. Blavier, J.M. Yoon, and Y.A. DeClerck. 2006. Modifying the soil to affect the seed: role of stromal-derived matrix metalloproteinases in cancer progression. Cancer Metastasis Rev. 25:35-43. [PUBMED]
- 27ab Duffy, M.J., P.M. McGowan, and W.M. Gallagher. 2008. Cancer invasion and metastasis: changing views. J Pathol. 214:283-93. [PUBMED]
