本页的话题有:
癌症是因为控制细胞的机能失效而形成的。机能失效的原因总是与重要基因的改变有关。这些改变常常由基因突变,或染色体的DNA序列变化而导致。基因突变可能是只影响几个核苷酸的小变化,或者是影响染色体结构重大改变变化的大变化。
小型和大型的突变都可以影响细胞的行为。重要基因的多重突变会导致癌症。本章的内容描述了变异和癌症的关联,不同种类的变异和它们的起因。
基因变异和癌症
恶性肿瘤表现出来的异常行为方式是重要调节基因(genes)的一系列突变所造成。随着更多基因受到损害, 细胞变得越来越不正常。常有这样的情况,控制DNA修复的基因本身受到损害,使细胞对越来越严重的基因受损更加敏感。
以下是展示染色体,基因和DNA关系的动画。
大多数恶性肿瘤被认为是起源于单个突变的前体细胞。当这样的前体细胞分裂时,形成的“子”细胞在经过一段时间后会出现不同的突变和行为。获得了细胞分裂机会或战胜了细胞死亡的那些细胞多半会“接管”整个细胞群体而起主宰作用。这样,癌症细胞就获得了各种正常的健康细胞所不具有的能力。癌症细胞的行为方式改变是本网站肿瘤生物学 (Cancer Biology) 章节所探讨的重点。
重要的调节基因(肿瘤抑制基因 tumor suppressors和原癌基因 proto-oncogenes)的突变会改变细胞的行为方式,并且可能导致在恶性肿瘤中可见的失控生长。
对所至今研究过的所有类型的癌症来说,正常健康细胞转变成癌症细胞似乎是一步步发生的,并且需要许多基因改变来累计形成癌症细胞。这种基因改变即发生在癌基因上也发生于肿瘤抑制基因。这就解释了为什么恶性肿瘤在上了年纪的人中要常见得多的原因。要形成恶性肿瘤细胞,同个细胞内必须发生一系列突变。既然任何基因发生突变的可能性很小,完全有理由认为几种不同突变发生在同一细胞里的可能性真的很小。因此, 70岁老年人机体内的细胞有更多时间垒积癌症发生所必需的突变,而小孩机体内的细胞获得必要的基因改变的可能性就要小得多。当然也有小孩患上恶性肿瘤的,但年纪较大的人患癌症的可能性是要大得多。下图显示的是在美因结肠癌发病率与年龄的关系。该图由美国国立癌症研究所提供。

如上图曲线变化可以得出这样的结论,正常细胞转变为癌性细胞需要多种基因变化。
在实验室里,研究人员一直在试图通过改变或导入关键性调节蛋白质以诱导肿瘤发生。几项研究尝试确定导致癌症细胞出现所需要的最低基因突变次数,其结果十分有趣。1
在自然中,基因突变在细胞内逐渐累积,“关键”基因组的变异可能导致癌症。 一项研究在2012年发现,健康人体内的骨髓干细胞可能在成长过程中积累许多变异。只要关键基因再发生几次变异就可能导致癌症。这个结果说明了再许多情况下,“正常”细胞核癌细胞并没有很大的区别。2
癌症的遗传性突变
显然,癌症形成所需要的突变可以有许多不同方式引起,这就使得问题比较复杂了。虽然所有癌症的生长和发展都得通过一系列相同的控制关卡,但是与之相关的基因可能各不相同。此外, 基因失控或丢失的发生顺序也可能不同。即使两个不同病人所患的癌症种类相同(例如结肠癌),所涉及到的肿瘤抑制基因和癌基因可能有很大的区别。
在肿瘤中的高度“异质性”(甚至在同一器官中)使得诊断与治疗变得十分复杂。目前,基于肿瘤的分子学分类的进展,我们能够根据在个例中实际涉及的基因来制定合理的治疗方案。新的诊断检测手段可以筛查数百个或数千个基因,以为病人建立个性化档案。这样的信息使得癌症患者能获得针对性很强的治疗。欲知更多内容,参看基因组/蛋白质组学部分。
导致细胞生长失控的基因突变可通过两种不同方式引起。基因突变可以经过数年逐渐形成,导致“散发性”的癌症;突变也可以通过遗传而获得,遗传性的异常功能的基因会导致家族遗传性癌症。已知的具有遗传性因素的癌症有:
- 乳腺癌- 通过遗传而获得变异的BRCA1 和 BRCA2 基因,是已知的乳腺癌的危险因素。虽然许多(如果不是大多数)乳腺癌患者并没有检测出这两个基因的突变,但是具有这样的突变会增加乳腺癌发生的可能性。
- 结肠癌- DNA 修复基因(如MSH2 )的缺陷使病人更易患上遗传性非息肉性结肠直肠癌(HNPCC )。
- 眼癌- Rb肿瘤抑制基因 (tumor suppressor)的缺陷会导致眼部癌症和几种其它类型的癌症。欲了解该病的更多内容,参看 Rb章节。
这里列出的遗传性癌症种类并不完整,并且可以肯定的是,随着对于癌症基因研究的进展,会识别出更多遗传性的癌症。
更多关于这个话题的内容可以在Robert A. Weinberg所著的《癌症生物学》(The Biology of Cancer)一书第二章与第四章中找到。
基因突变的类型
蛋白质(proteins)的合成过程(即翻译)(translation)是基于mRNA的“解读”功能。而mRNA的“解读”功 能是通过转录(transcription)过程而获得的。拥有基因编码的DNA的改变会导致mRNA的改变。而改变了的 mRNA又可能导致功能异常的蛋白质的形成。甚至DNA链上的单个核苷酸(nucleotide)的改变都可能导致蛋白质完全丧失功能。
DNA可以被几种方法改变。以下的页面详细描述了不同种类的基因变化。
点突变的影响
基因变异分为两类。第一类是在DNA链上只有一个或几个核苷酸发生突变。这样的突变称为点突变 (point mutations)。
当核糖体“解读”信使RNA分子,每三个核苷酸被翻译成一个氨基酸。这样的三位“密码”被称为密码子。以英语句子作为类比:“The fat cat ate the rat” 这句话含有6个密码子. 基因突变带来的类似这样的变化:“The fat bat ate the rat.” 或 “The fa' 或 'The fat oca tat her at...” 给蛋白质带来的影响取决于基因变异的位置和类型。
被核糖体解读的三位密码子可能被基因突变以以下三种方式之一改变:
无义突变
新密码子使蛋白质提前中止合成,这样得到的蛋白质呈缩短状,常常无功能。

错义突变
新密码子使错误氨基酸(amino acid)插入蛋白质。对该蛋白质功能的影响决定于什么氨基酸在插入位取代正常氨基酸。
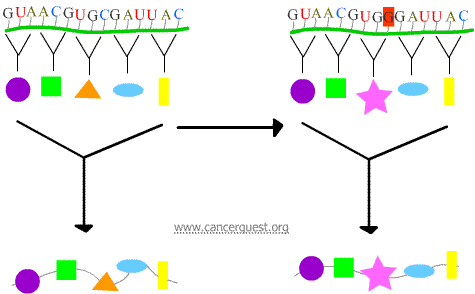
移码突变
丢失或增加一个或两个核苷酸导致受影响密码子被错误解读,随即出现所有密码子被错误解读。最终形成的蛋白质的差异很大,常常无功能。

转录错误
DNA损伤可能导致单个或一小组的核苷酸改变,这些改变了的的核苷酸不能被RNA聚合酶“解读”。当RNA聚合酶复合体到达这些位置时,它们有时会为了继续移动而添加核苷酸来“绕过”这些DNA损伤,即使它们添加的是错误的核苷酸。这个过程被称作为转录突变,它在癌症发展中起到了重要的作用。3
易位
基因突变的第二种类型涉及到较大量DNA突变,而且常常在染色体(chromosome)这一层面上。这些变化被称为易位,并且涉及到染色体片段的断裂和移动。常常是两个不同染色体内出现断裂伴随着基因的重新结合,导致两个“新”染色体形成。
可能看起来易位并不会造成很大的问题,因为所有基因依然存在;事实上,这些改变却能以多种方式导致失控性细胞生长-
1. 这些基因在新的位置上可能得不到恰当的转录和翻译。
2. 基因的移动导致转录 (transcription)程度的增加或减少。
3. 断裂和重组也可以在基因内发生(如上图绿色显示),导致基因失活。
特殊的易位在一些癌症中很常见,并且可以被用于诊断这些癌症。易位在白血病(leukemias )和淋巴瘤(lymphomas)中常见,而在实体性恶性肿瘤中较不常见。例如,9号和22号染色体的交换在90%以上的慢性髓细胞性白血病(chronic myelogenous leukemia)病人中都可以看到。染色体交换导致了22号染色体缩短,缩短的22号被称为“费城染色体”(以发现它的地方命名)。这样的易位导致了原癌基因abl的产生。4, 5
其他经常(或总是)与易位有关的癌症包括了伯基特氏淋巴瘤(Burkitt's lymphoma),B细胞淋巴瘤(B-cell lymphomas)和几种白血病。
基因扩增
在不正常的基因扩增过程中,正常DNA复制(replication)过程出现严重“漏洞”。结果是,从染色体 (chromosome)某一区域复制出的不是一个复制本而是许多个复制本。这就导致了这个区域的基因(genes)复制本也是许多个。有时,扩增区域的复制本产量如此多,以至于它们实际上形成了自己的小的假染色体,也叫做双微体染色体。

每个复制本上的基因都可以被转录和翻译,导致扩增基因所对应的mRNA和蛋白质(protein)的过度合成,如下所示。图中曲线表示通过基因复制本转录形成的mRNA。
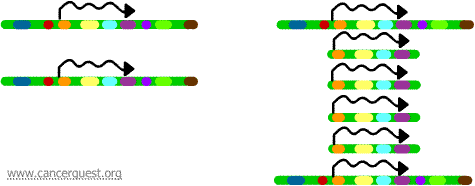
这种过程不存在于正常细胞中,但是在癌症细胞中却很常见。如果癌基因(oncogene)位于扩增区域,那么基因的过度表达(overexpression)则可导致细胞生长的失控。例如,许多肿瘤中的myc癌基因的扩增(amplification),和乳腺癌和卵巢癌中ErbB-2或HER-2/neu癌基因的扩增。对HER-2/neu癌基因的临床治疗主要针对那些过度表达蛋白质产物的细胞。
基因的过度表达也会带来癌症治疗中的另一个大问题:抗药性。抗药的肿瘤在化疗药物存在的情况下仍能继续生长和传播。一个普遍参与其中的的基因叫做MRD(multiple drug resistance 多重抗药性)。这个基因的产物是细胞膜上的泵蛋白(运输蛋白)。它能选择性地从细胞中排出分子,包括化疗药物。这种移除使药物失去效果。
这些内容会在“抗药性"一章中会更详细地介绍。不同基因的扩增能使不同的化疗药物失效。
倒位、重复、缺失、非整倍体
倒位
在这样的改变中,DNA节段从染色体(chromosome)中释放出来,然后以反方向再插入。正如以上例子所述,通过激活癌基因(oncogene)或使肿瘤抑制基因(tumor suppressor)失活,这种重新排列使基因异常表达。
重复/缺失
由于复制错误(replication errors),一个基因或一组基因在染色体内可复制不止一次。这不同于基因扩增(gene amplification),因为这种基因的复制不会超出染色体,而且只被复制一次,不是成百上千次。这些基因可能由于复制过程的失败或其它的基因损伤而丢失。

非整倍体
非整倍体是与整个染色体的丢失或增加有关的基因改变。由于细胞分裂过程中出现的问题,复制出的染色体没有被准确地分离而进入两个子细胞。这就导致染色体过多或过少。唐氏综合征中的非整倍体(此与恶性肿瘤无关)就是一个常见的例子,病人所有细胞中的第21号染色体都多了一个复制本。
在以下的动画中,染色体被复制成两个副本,但当细胞分裂时,染色体没有被平均地分入两个新形成的细胞(子细胞)。其结果是,一个细胞有过多的染色体,而另一个没有足够的染色体。
非整倍体在癌症中十分常见的。正常的人类细胞有46个染色体,但是恶性肿瘤细胞的染色体要多许多,有时超过100。过多染色体的存在使得细胞不稳定,严重影响细胞分裂的控制。关于是否所有癌症细胞都是非整倍体,目前尚有争议。无论结果怎样,有一点是十分明确的,那就是非整倍体是癌症细胞的一个常见特征。
表观遗传性变化
除了DNA序列的改变外, 基因表达也可因另一种DNA和染色质改变而变化,这类型改变不会改变DNA序列。因为这种改变不影响基因中的DNA序列,所以被称为表现遗传性变化(epigenetic changes)。表现遗传性变化有以下两种类型。
甲基化
在此变化中,DNA 中的一些核苷酸(nucleotides)因有甲基(-CH3) 添加到碱基上而被改变。这样的DNA甲基化伴有DNA的某一区域的失活。异常的DNA甲基化已见于癌症细胞。如上所述,甲基化改变受影响基因的表达。
乙酰化
在此类型的表现遗传性变化中,环绕DNA螺旋的组蛋白因乙酰基 (-CH3CHO) 的添加而被改变。这样的改变导致DNA和组蛋白的相互作用减弱,并伴有基因表达的增强。乙酰基添加到DNA 上或乙酰基从DNA 上除去所引起的变化是目前癌症治疗研究中所关注的一个热点。
更多信息,请参看表现遗传性变化和癌症治疗。
突变的原因
正如我们已经知道的那样,恶性肿瘤细胞是由正常前体细胞演变而来,而这种演变是因为基因受损的垒积。导致这种改变的机制有多种。一般说来,基因突变的方式大致分为三类,我们将逐一详细介绍。
自发突变
自发突变:DNA中的碱基可因为未被修复的复制错误(replication error)或分子偶发事故(random molecular events)而改变或丢失。例如,胞核嘧啶(DNA 中的正常碱基)中的氨基丢失可导致尿嘧啶形成(正常DNA 中不存在的碱基)。如果这种改变未被发现和纠正,则可能导致突变。偶尔,整个碱基可能因DNA主链与碱基之间的连结键断裂而丢失。这导致DNA双螺旋出现裂口;如果不修复,则可导致下一次DNA复制过程中突变的发生。
诱发突变
诱发突变:突变可能由机体(或细胞)倍多种情况诱发。一些常见的诱发突变有:
辐射 - 这是最先了解的突变原(mutagens)之一。 辐射(radiation)是很强的突变诱发物。不同种类的辐射诱发不同种类的基因突变。紫外线(UV)诱发点突变(point mutations)。X射线诱发DNA双螺旋的断裂,并导致易位,倒位和其它类型的染色体损害。与阳光中紫外线的接触与皮肤癌的发生有关。值得注意的是,辐射能导致DNA损伤这一特性已被用在几种不同的基于辐射的癌症治疗方法中。
以下展示的是受紫外线辐射引起的一种突变。在这个例子中,紫外线对DNA双螺旋的“轰击”导致两个碱基链接在一起。这改变了DNA的结构,若不被修复的话可能导致永久性变化。
放射性元素(比如氡和铀)或核反应堆中的人造能源的能量释放带来另一种辐射。这种类型的辐射有不同的类型,并可能导致不同类型的细胞和组织损伤。辐射可直接损伤DNA,或可能导致化学成分(即活性氧)的形成,活性氧可能破坏DNA或其它细胞成分。
历史上放射性物质带来的和辐射有据可查。对日本第二次世界大战期间原子弹爆炸幸存者的分析显示出,在接触核辐射不久后,白血病发病率大量增加,其他类型的癌症也在接下来的几十年内增加。6
核电站也可能意外释放出大量危险的辐射物质。切尔诺贝利核反应堆的意外核泄漏被认为与甲状腺癌和其他癌症发病率的增长有关。7
医学影像设备(比如X光和CT扫描)也会给病人带来辐射。单次检测时受到的辐射并不会导致大量癌症案例,但是长期接受多次检测的影响还尚不清楚。8 类似的,飞机乘客在机场接受的全身扫描也不会导致癌症。9 飞机乘客在0飞行途中也会受到来自太空的辐射,但是这种轻微的辐射并不会增加患癌症的风险。即使是飞机乘务人员也不会受到影响。9, 10
化学突变原:我们已经了解到,许多不同的化学物质会导致突变。机制是它们与DNA 结合或与DNA的某些成分结合,干扰了正常的复制( replication ) 或转录(transcription) 。例如,苯并芘和黄曲霉素都属于强突变源。苯并芘是香烟烟雾中的一种化学物质;黄曲霉素最常见于储存不当的农产品中。
慢性炎症:慢性炎症(chronic inflammation)可导致DNA 损害,这是由免疫系统细胞所产生的化学突变源所致。例如,肝炎病毒可引起慢性炎症。了解更多病毒和癌症的信息。
氧自由基:在从食物中获取能量的过程中(发生在线粒体mitochondria内),可能产生一些化学物质。这些化学物质非常活跃且能破坏细胞膜和DNA 。这样的活性氧中间物(ROI: reactive oxygen intermediates)可因细胞受到辐射而产生,如下所示。
活性氧中间物的诱变活性与癌症的发展有关,共识也与抗癌治疗(包括放射治疗和化学治疗)有关。 11, 12, 13
异常细胞分裂
在有丝分裂(mitosis)期间,细胞可能没能在分裂过程中将复制的染色体准确地分配到两个子细胞中。这种类型的错误会导致非整倍体自曝的产生。这种细胞丢失或者额外获得许多基因。这种罕见的过程可能制造出更多细胞分裂失控的细胞。如上所述,人类的大部分癌症都属于多倍体。
如果一个细胞的突变基因正好是“控制”细胞分裂过程,那么情况很快会失控,每次分裂产生的子细胞都会变得更不正常。
病毒和突变
病毒被认为是与很多癌症的形成有关。病毒可以以多种方式导致癌症,并且每种病毒作用的方式都略有不同。一些病毒(包括逆转录病毒)能通过把自己的基因插入到受感染细胞的基因组中而导致变异。被插入的DNA可以损坏或者改变受影响基因的活动。14, 15, 16
病毒可以直接导致基因突变。比如:肝炎病毒感染可能持续很多年。期间,体内的防御系统可能通过产生有毒性的化学分子来驱赶病毒。 这些化学分子可能损伤本来健康的“旁观者”细胞,并且使它们走上癌变的路。 病毒有很多导致癌症的方法。17, 18
因为病毒在癌症形成中的重要性,我们建立了专门讨论病毒与癌症的章节。
转座子和突变
转座子是一段很短的DNA序列,它能够从DNA上的一个位置转移到另一个位置。转座子为转座酶编码,转座酶可以把转座子拼接到基因组上的新位置(左下图展示了一个转座子)。转座子被芭芭拉·麦克林托克(Barbara McClintock)发现,她因此赢得了诺贝尔奖。19, 20 人类的基因组包含了很多的失或到转座子副本,这些转座子失去了它们移动或者”跳跃“到新位置到能力。 大约50%到人类基因都包含了“失活“的转座子。21
活跃的转座子的移动可能通过改变基因的活动带来基因突变。转座子的活动(转位)的一个明显的例子是印度玉米颗粒的颜色(见右下图)。人体内活跃的转座子被认为与人类疾病有关,包括癌症。22, 23, 24


基因突变总结
基因变化(突变)简介
- 癌细胞的异常表现是由于关键调节基因(即DNA修复基因)的一系列变异导致的。
- 大多数癌症被认为是由累积了足够基因变异而形成癌细胞的单个细胞发展而成的。
DNA突变
- 基因变化可能很小:只影响单个或几个核苷酸(点突变),或者很大:改变一个或者几个染色体的结构
- 点突变
- 翻译是酶通过沿着信使RNA(mRNA)“读”由三个核苷酸构成的“字符“(密码子)来合成蛋白质。
- 即使只改变基因DNA链一个核苷酸都会使蛋白质完全失去功能。基因突变被根据它们给基因蛋白质产物带来的影响分类:
- 无义突变 - 新的(变异的)密码子导致蛋白质合成提前停止。
- 错义突变 - 被改变的密码子导致错误的氨基酸插入蛋白质。
- 移码突变 - mRNA中一两个核苷酸的丢失或增加导致密码子被错误地解读。常常导致缩短的或者无功能的蛋白质。
- 染色体层面的变化
- 易位 - 染色体片段的断裂和(有时)片段的交换。
- 基因扩增 - 非正常的复制形成了染色体上某个区域的多个副本。最终这会导致对应基因的过度生产。
- 倒位 - DNA片段从一个染色体上释放,并且反方向重新插入。
- 重复/缺失 - 一个基因或者一组基因可能一起丢失或者在一条染色体上被多次复制。
- 非整倍体 - 丢失或者获得整条染色体的基因变化。
- 自发性变异可能由未被修复的DNA或者随机的分子事件导致。
- 癌细胞中非整倍体非常常见。
表现遗传性变化
- 基因表达可能由于DNA和染色体不改变基因序列的改变而变化。比如DNA的甲基化和组蛋白的乙酰化。
- 甲基化 - DNA中的一些核苷酸由于甲基的添加而改变。这样的DNA甲基化伴有DNA的某一区域的失活。
- 乙酰化 - 乙酰基的添加使DNA链松开,并增强基因表达。
诱发突变
- 生物体(或细胞)与以下几种处理的接触可能导致变异:
- 辐射 - 紫外线导致点突变,X射线导致多种伤害。
- 化学诱变剂 - 可以绑定到DNA的DNA组成部分上,并且干扰复制或转录过程。
- 慢性炎症 - 免疫系统的细胞生产的诱变化学物质导致DNA损伤。
- 氧自由基 - 在细胞的能源生产过程中产生,并能损害DNA。
其他基因变化
- 不正常的细胞分裂导致不正确染色体的分裂,并产生非整倍体。
- 病毒可以由多种方式导致基因损伤,这与很多癌症有关。
基因突变和癌症
- 从一个正常的,健康的细胞变为癌细胞是一个逐步发展的过程。
- 癌症的发展需要多个不同癌基因和癌症抑制基因的基因变化。
- 为了生长和发展,所有的癌症都必须克服一系列相同的调节机能,但是所涉及的基因可能有所不同。
- 癌症的异质性使得诊断和治疗变的困难。
- 家族遗传性的特定癌症可能由于遗传了功能失调的基因导致。
了解流程:基因突变
“了解流程”是一个测试您知识的互动教育游戏。开始游戏:
- 从右边栏选择适当的选项,并将它们拖入左边相对应的方框中。请注意,您将只使用六个选项中其中五个来完成游戏。
- 完成后,请点击“查询”来查看您的正确率。
- 对于不正确的答案,可单击“说明”来复习相关信息。
- 如果想要再试一次,请选择“重置”并重新开始游戏。
Please visit us on a larger screen to play this game.
填字游戏:基因突变
- 1 Hahn WC, Counter CM, Lundberg AS, Beijerbergen RL, Brooks MW, Weinberg RA. "Creation of human tumour cells with defined genetic elements." Nature 400: 464-468 [PUBMED]
- 2 Welch JS, Ley TJ, Link DC, Westervelt P, Walter MJ, Graubert TA, DiPersio JF, Ding L, Mardis ER, Wilson RK et al. The origin and evolution of mutations in acute myeloid leukemia. Cell, July 20, 2012 [http://www.sciencedirect.com/science/article/pii/S0092867412007775] [PUBMED]
- 3 Brégeon D, Doetsch PW. Transcriptional mutagenesis: causes and involvement in tumour development. Nat Rev Cancer. 2011 Mar;11(3):218-27. [http://www.nature.com/nrc/journal/v11/n3/full/nrc3006.html#abs] [PUBMED]
- 4 Nowell PC, Hungerford DA. "Chromosome studies on normal and leukemic human leukocytes." J Natl Cancer Inst (1960). 25: 85-100.
- 5 Rowley JD. "A new consistent chromosomal abnormality in chronic myelogenous leukemia identified by quinacrine fluorescence and Giemsa staining." Nature (1973). 243: 290-293. [PUBMED]
- 6 Ozasa K, Shimizu Y, Sakata R, Sugiyama H, Grant EJ, Soda M, Kasagi F, Suyama A. RISK OF CANCER AND NON-CANCER DISEASES IN THE ATOMIC BOMB SURVIVORS. Radiat Prot Dosimetry. 2011 Apr 18. [Epub ahead of print] [PUBMED]
- 7 Cardis E, Hatch M. The Chernobyl Accident-An Epidemiological Perspective. Clin Oncol (R Coll Radiol). 2011 Mar 9. [Epub ahead of print] [http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6WXW-52BVPYJ-1&_user=655046&_coverDate=03%2F10%2F2011&_rdoc=1&_fmt=high&_orig=gateway&_origin=gateway&_sort=d&_docanchor=&view=c&_acct=C000034138&_version=1&_urlVersion=0&_userid=655046&md5=e8e4228a274d051c93802e42b7406318&searchtype=a] [PUBMED]
- 8 Fazel R, Krumholz HM, Wang Y, Ross JS, Chen J, Ting HH, Shah ND, Nasir K, Einstein AJ, Nallamothu BK. Exposure to low-dose ionizing radiation from medical imaging procedures. N Engl J Med. 2009 Aug 27;361(9):849-57. [http://www.nejm.org/doi/full/10.1056/NEJMoa0901249] [PUBMED]
- 9ab Mehta P, Smith-Bindman R. Airport Full-Body Screening: What Is the Risk? Arch Intern Med. 2011 Mar 28. [Epub ahead of print] [http://archinte.ama-assn.org/cgi/content/full/archinternmed.2011.105v1] [PUBMED]
- 10 Bagshaw M. Cosmic radiation in commercial aviation. Travel Med Infect Dis. 2008 May;6(3):125-7. Epub 2007 Nov 26. [http://www.travelmedicinejournal.com/article/S1477-8939%2807%2900133-0/abstract] [PUBMED]
- 11 Kang DH. "Oxidative Stress, DNA damage and breast cancer." AACN Clin Issues. (2002). 13:540-549 [PUBMED]
- 12 Athar M. "Oxidative stress and experimental carcinogenesis." Indian J. Exp. Biol. (2002). 40:656-667 [PUBMED]
- 13 Marnett LJ. "Oxy radicals, lipid peroxidation and DNA damage." (2002)181-182:219-222 [PUBMED]
- 14 Nair V. Retrovirus-induced oncogenesis and safety of retroviral vectors. Curr Opin Mol Ther. 2008 Oct;10(5):431-8. [PUBMED]
- 15 Brady G, Macarthur GJ, Farrell PJ. Epstein-Barr virus and Burkitt lymphoma. Postgrad Med J. 2008 Jul;84(993):372-7. [PUBMED]
- 16 Ruprecht K, Mayer J, Sauter M, Roemer K, Mueller-Lantzsch N. Endogenous retroviruses and cancer. Cell Mol Life Sci. 2008 Nov;65(21):3366-82. [PUBMED]
- 17 Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis. World J Gastroenterol. 2007 Jan 7;13(1):74-81. [PUBMED]
- 18 Castello G, Scala S, Palmieri G, Curley SA, Izzo F. HCV-related hepatocellular carcinoma: From chronic inflammation to cancer. Clin Immunol. 2010 Mar;134(3):237-50. Epub 2009 Nov 11. [PUBMED]
- 19 McClintock B. The origin and behavior of mutable loci in maize. Proc Natl Acad Sci U S A. 1950 Jun;36(6):344-55. [PUBMED]
- 20 McClintock, Barbara Nobel Prize lecture [http://www.nobelprize.org/nobel_prizes/medicine/laureates/1983/mcclintock-lecture.html]
- 21 Burns KH, Boeke JD. Human transposon tectonics. Cell. 2012 May 11;149(4):740-52. [PUBMED]
- 22 Kozeretska IA, Demydov SV, Ostapchenko LI. Mobile genetic elements and cancer. From mutations to gene therapy. Exp Oncol. 2011 Dec;33(4):198-205. [PUBMED]
- 23 Solyom S, Kazazian HH Jr. Mobile elements in the human genome: implications for disease. Genome Med. 2012 Feb 24;4(2):12. [PUBMED]
- 24 Iskow RC, McCabe MT, Mills RE, Torene S, Pittard WS, Neuwald AF, Van Meir EG, Vertino PM, Devine SE. Natural mutagenesis of human genomes by endogenous retrotransposons. Cell. 2010 Jun 25;141(7):1253-61. [PUBMED]
