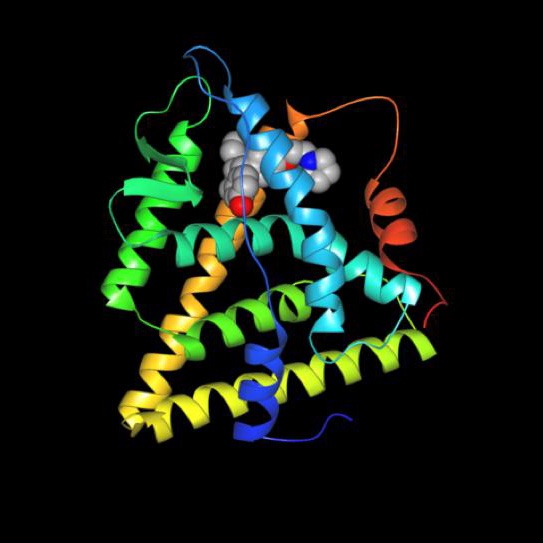
所有细胞都对其他细胞发出的信号作出反应。细胞交流的一种主要方式是激素。激素可以是小蛋白(如胰岛素),也可以是类固醇(如雌激素和睾酮)。信号细胞产生激素,该激素漂浮在靶细胞上并与靶细胞结合(或进入靶细胞),从而导致行为改变。激素可以导致细胞产生新的蛋白质,或者停止生产已经生产的产品。激素信号的一个可能结果是靶细胞的生长和繁殖。
癌症细胞虽然异常,但可能保留对激素信号作出反应的能力。大多数以激素为基础的癌症治疗方法背后的理念是让癌症细胞缺乏激素信号,否则会刺激癌细胞分裂。这些治疗中使用的药物通过阻断靶细胞中激素的活性来发挥作用。一些正在研究中的新疗法旨在阻止激素的产生,在一开始就切断信号。一些类型的乳腺癌、卵巢癌和前列腺癌症需要接受激素治疗。
激素治疗通常与手术和/或放疗和/或化疗相结合。在这些情况下,激素治疗被称为“辅助”治疗。

激素是在一个细胞中产生的信号来影响不同的细胞。在上面的动画中,绿色化学物质被蛋白质机器(酶)转化为红色激素。一些激素会导致癌症细胞繁殖。
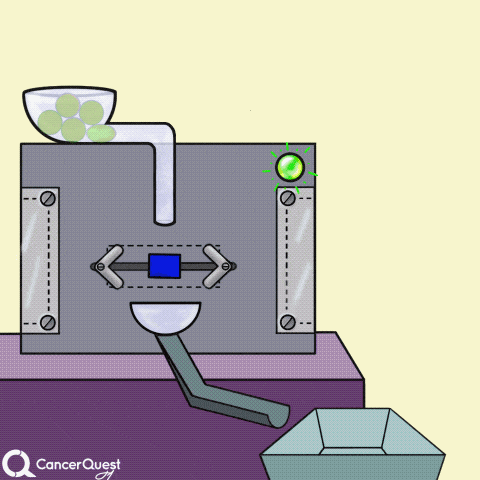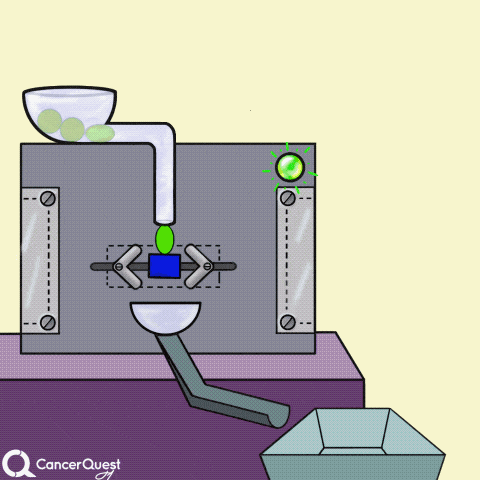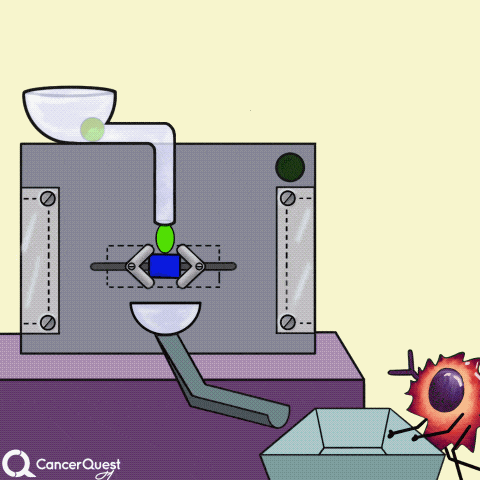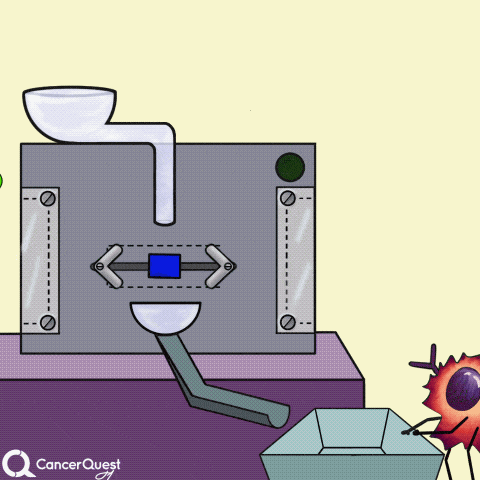
一些癌症药物(蓝色长方形)可以阻断产生激素的酶(如雌激素)。

癌症药物(蓝色三角形)也可以防止激素粘附或进入癌症细胞。它们还可以“干扰”细胞内的激素受体。无论哪种方式,激素的信号都会被阻断。
下面描述的激素疗法都是通过干扰激素信号来起作用的,但如上所示,它们可能会攻击信号通路的不同部分来减缓癌症的生长。不同种类的激素抑制剂(也称为“拮抗剂”)包括:
- 选择性雌激素受体调节剂 (SERMs): 这些药物通过干扰雌激素受体的活性发挥作用。以这种方式起作用的药物包括他莫昔芬 (Nolvadex®),雷洛昔芬 (Evista®) 和托雷米芬 (Fareston®)
- 芳香化酶抑制剂: 这些药物通过阻断雌激素前体产生雌激素的酶来发挥作用。以这种方式起作用的药物包括阿那曲唑 (Arimidex®),依西美坦 (Aromasin®) 和来曲唑 (Femara®)。
- 受体下调因子: 这类药物通过降低雌激素受体的水平来发挥作用。 氟维司群(Faslodex®) 属于这类药物。
- 选择性雄激素受体调节剂 (SARMs):这些药物通过干扰雄激素受体的活性发挥作用。以这种方式起作用的药物包括氟他胺 (Eulexin®) 和比卡鲁胺 (Casodex®).
- 其他激素治疗:这些药物以上述类别未涵盖的方式影响激素的产生或活性。这些药物的作用方式可能并不完全清楚。这类药物的一个例子是兆斯特罗 (Megace®).
- 激素治疗术语表: 一个易于使用的激素治疗药物表,包括商品名、通用名和类型。包含指向其他信息的链接。
- 了解流程:激素治疗: 关于激素治疗癌症的交互式自测。
选择性雌激素受体调节剂 (SERMs)
许多 乳腺癌 患者的肿瘤是由自然产生的激素、雌激素驱动的。雌激素的正常活动之一是引起乳腺和子宫中细胞的繁殖;每个月都必须为乳腺(乳房)和子宫内膜(子宫)创造新的细胞衬里。在一些乳腺癌症患者中,雌激素的正常表达有助于癌症细胞的生长和分裂。对于这些患者,使用选择性雌激素受体调节剂(SERM)(也称为抗雌激素)进行治疗是合适的。
这些药物通过改变雌激素受体 (ER)的形状来阻止激素的作用。这些药物只影响一部分能够对雌激素产生反应的细胞,但这种选择性的确切机制尚不清楚。正是这种选择性作用使这些药物赢得了它们的名字。靶细胞中雌激素的阻断会导致基因表达的变化,并改变细胞的行为,阻止细胞分裂。1
1992年, 三苯氧胺 成为第一种用于治疗乳腺癌症的血清增强剂。虽然它确实减少了乳腺中的雌激素效应,但不幸的是,它在子宫中具有促进雌激素活性,导致三苯氧胺治疗乳腺癌癌症患者的子宫癌症发病率上升。2
最近,人们对 雷洛昔芬 等新一代SERM作为乳腺癌症治疗药物的潜力进行了研究。这种药物似乎对乳腺和子宫组织都有抗雌激素作用。1999年进行的两项为期六个月的研究表明,雷洛昔芬不会刺激子宫内膜生长。对969名服用雷洛昔芬的绝经后妇女的研究表明,与服用安慰剂的妇女相比,使用该药物治疗不会导致子宫内膜厚度显著增加。3
STAR试验的结果表明,雷洛昔芬在预防绝经后女性侵袭性乳腺癌症方面与三苯氧胺相当,且副作用有所改善。4, 5, 6
在2007年,美国食品和药物管理局批准了盐酸雷洛昔芬片 (EVISTA, Eli Lilly 和公司) 以降低绝经后骨质疏松症妇女和绝经后高危浸润性乳腺癌症妇女患浸润性乳腺癌的风险。7, 8, 9
他莫昔安 (Nolvadex®)
雷洛昔芬 (Evista®)
托雷米芬 (Fareston)
抑制剂和下调剂
额外的激素治疗方法已经被开发出来了,可以作为SERM(他莫昔芬/雷洛昔芬)治疗的替代品,或者在SERM无效的情况下使用。 三苯氧胺和雷洛昔芬都被设计为在雌激素进入靶细胞后干扰雌细胞的作用。还有其他几个攻击点可以用来防止通过雌激素发出信号。最直接的方法是通过阻断负责雌激素形成的酶芳香化酶来阻止雌激素的产生。
第二种方法是去除雌激素的靶点(雌激素受体)。这两种治疗方法都是为治疗癌症而开发的。因为这些激素治疗阻断了雌激素的产生或功能,它们可能对怀孕产生负面副作用。因此,它们被用于治疗绝经后妇女。10
芳香酶抑制剂
绝经后,女性产生的雌激素水平持续较低,这种雌激素来源于雄激素前体。这些前体通过芳香化酶的作用转化为雌激素。芳香化酶抑制剂通过阻断这种酶的作用来阻止雌激素的形成。有两种类型的芳香化酶抑制剂已被批准用于治疗雌激素受体阳性转移性乳腺癌绝经后妇女:类固醇抑制剂,如依西美坦 (Aromasin®) 和会结合芳香酶的非甾体抑制剂(阿那曲唑和来曲唑)。10
这些药物的优点是它们没有增加子宫内膜癌症风险的副作用。10
因为芳香酶抑制剂会干扰性激素雌激素的活性,所以它们确实会产生影响性功能和满意度的额外副作用。11
雌激素受体下调因子
通过降低雌激素受体的浓度及其活性,雌激素的作用可以被抵消。
选择性雄激素受体调节剂 (SARMs)
睾酮和二羟基睾酮 (DHT) 是在睾丸和肾上腺中产生的两种激素(雄激素)。在其他活动中,这些激素与前列腺细胞中的特定受体结合。这种结合的正常功能是调节前列腺细胞的生长,然而,在癌症细胞中,这种调节受到损害。雄激素与癌症细胞中的受体结合,促进其生长和分裂。
抗雄激素分子已经被开发出来,可以进入细胞并阻止睾酮与受体蛋白的结合。这是通过药物分子与雄激素受体的优先结合而发生的。药物的结合阻止雄激素与癌细胞的结合,从而降低其促生长的活性。12
比卡鲁胺(Casodex®)
氟他胺 (Eulexin®)
尼鲁他胺 (Nilandron®, Anandron®)
这些药物经常与手术联合使用,以最大限度地降低雄激素水平。13医学数据库 此外,还正在研究其他药物降低前列腺癌症雄激素水平的能力,并克服一些患者的耐药性。14, 15
额外的激素治疗
额外的药物已被开发出来用以干扰激素控制的细胞分裂。这些药物可能模仿自然产生的激素,也可能通过新奇的或未知的机制发挥作用。这类药物的例子包括:
甲地孕酮 (Megace): 这种药物会干扰雌激素的产生和/或活性。 16
了解流程:激素治疗
了解流程 是一个教育游戏,让你测试自己的知识。要播放:
- 从右侧列表中拖动相应的选项,并将它们按顺序放置在左侧的框中。请注意,您将只有使用六个选项中的五个来完成游戏。
- 完成后,点击“检查”查看有多少是正确的。
- 对于不正确的答案,请单击“描述”查看有关流程的信息。
- 若要重试,请选择“重置”并重新开始。
Please visit us on a larger screen to play this game.
- 1 Katzenellenbogen B, Katzenellenbogen J. "Defining the "S" in SERMs". Science (March 29, 2002). 295: 2380-2381. [PUBMED]
- 2 Shang, Y Brown, M. "Molecular Determinants for the Tissue Specificity of SERMS". Science (March 29, 2002). 295: 2465-2468. [PUBMED]
- 3 Scott J, Da Camara C, Early J. "Raloxifene:A Selective Esrogen Receptor Modulator". American Family Physician (September 1999). [http://www.aafp.org/afp/990915ap/1131.html]
- 4 Vogel, V., Costantino, J., Wickerham, L., Cronin, W., Cecchini, R., Atkins, J., … Project, N. (2006). Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 trial. JAMA, 295(23), 2727–41. (Original work published 2006年6月) [PUBMED]
- 5 Land SR; Wickerham DL; et.al. Patient-Reported Symptoms and Quality of Life During Treatment With Tamoxifen or Raloxifene for Breast Cancer Prevention: The NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 Trial. JAMA. 2006;295:2742-2751. Published online June 5, 2006. [PUBMED]
- 6 Vogel VG The NSABP Study of Tamoxifen and Raloxifene (STAR) trial. Expert Rev Anticancer Ther. 2009 Jan;9(1):51-60. Erratum in: Expert Rev Anticancer Ther. 2009 Mar;9(3):388. [PUBMED]
- 7 https://www.accessdata.fda.gov/drugsatfda_docs/nda/2007/022042s000_Approv.pdf
- 8 https://www.accessdata.fda.gov/drugsatfda_docs/nda/2007/022042_evista_toc.cfm
- 9 "Understanding Estrogen Receptors, Tamoxifen and Raloxifene". National Cancer Institute. [http://newscenter.cancer.gov/sciencebehind/estrogen/estrogen00.htm]
- 10abc Bentram DJ. "Role of Antiestrogens and Aromatase Inhibitors in Breast Cancer Treatment." Current Opinion in Obstetrics and Gynecology (2002). 14: 5-12. [PUBMED]
- 11 Baumgart J, Nilsson K, Evers AS, Kallak TK, Poromaa IS. Sexual dysfunction in women on adjuvant endocrine therapy after breast cancer. Menopause. 2012 Sep 17. [Epub ahead of print] [PUBMED]
- 12 Nguyen MM, Wang Z. Manipulation of androgens and alterations in the androgen receptor axis in prostate cancer. Minerva Urol Nefrol. 2008 Mar;60(1):15-29. [PUBMED]
- 13 Klotz L. Maximal androgen blockade for advanced prostate cancer. Best Pract Res Clin Endocrinol Metab. 2008 Apr;22(2):331-40. [
- 14 Chen Y, Clegg NJ, Scher HI. Anti-androgens and androgen-depleting therapies in prostate cancer: new agents for an established target. Lancet Oncol. 2009 Oct;10(10):981-91. [PUBMED]
- 15 Klotz L. Maximal androgen blockade for advanced prostate cancer. Best Pract Res Clin Endocrinol Metab. 2008 Apr;22(2):331-40. [PUBMED]
- 16 Phase II study of high-dose megestrol acetate in platinum-refractory epithelial ovarian cancer. Wilailak, Sarikapan1; Linasmita, Vasant1; Srisupundit, Somkeart. Issue: Volume 12(9), October 2001, pp 719-724 [PUBMED]
