点击观看Adam Marcus医生关于针对癌症转移的TEDx视频。
靶向治疗的发展标志着一个激动人心的癌症疗法的诞生。美国食品药品监督管理局已经批准了一小部分药品,而还有一些靶向疗法药品正在临床实验的过程中。在2017年8月,科罗拉多大学癌症中的研究员们进行了一项针对肺癌患者的实验。他们评估了总体生存率和无恶化生存率——后者也可理解为肿瘤复发所需的时间。研究员们发现,“免疫疗法有更好更深层的响应,但是与针对ALK阳性肿瘤的靶向治疗的方法仍有不同。”这表明,在该研究的肺癌患者群体中,数据显示更深层的响应能够更长效。这也指出,疗法的响应深度可以为患者和医师提供比较治疗方案的更好依据。1
下文涵盖要点:
- 靶向治疗和传统化疗
- 激酶抑制剂: 激酶是将磷酸基团转移至其他蛋白质的酶。因为它们能控制细胞活动,所以非正常活动会导致癌症的产生。
- 抗体疗法 : 抗体是人体免疫系统中自然产生的蛋白质。人工设计的抗体可用来治疗一系列癌症。
- 血管再生抑制剂: 血管再生是几乎任何肿瘤生长的重要条件。
- 蛋白酶体抑制剂: 蛋白酶体负责分解蛋白。对蛋白酶体的抑制可用来治疗多种癌症。
- 分子受体阻断剂: 细胞之间、细胞之内都有信息传递。非正常的信息通道会导致癌症,而一些疗法通过干扰一些信息通道来治疗癌症。
- 组蛋白乙酰转移酶(HAT)和组蛋白脱乙酰酶(HDAC): DNA是所有细胞活动的蓝图。获取这一信息的方式受到DNA修饰的控制,其中包括在与DNA结合的蛋白上添加或移除一些小的化学基团(乙酰基团)。
- 组蛋白脱乙酰酶(HDAC)抑制剂: 在组蛋白上增加或一处乙酰基团会导致对DNA活动有巨大影响的修饰变化。通过改变这一“乙酰密码”可以治疗癌症。
- 反义药物:反义RNA可以干扰在DNA转录中产生的信使RNA(mRNA) 的正常活动。
- 核酶: 核糖体是有酶的(催化)功能的RNA分子。这和一般蛋白质酶的理解有所不同。
- 酶活化剂:癌症可以导致关键酶的失活。一些癌症治疗方法就是通过重新激活这些酶来治疗癌症的。
- 了解流程:靶向治疗
目前最有前景的有针对性的癌症药物开发主题就是定位癌症细胞,而非正常细胞,特有的活动。因为这些药物并不是直接毒性,而且只对癌症细胞有效,他么希望这样有针对性的方法能够减少副作用。2 不过目前这些药物的特异性的确有一个缺点:只抑制一条癌症细胞通信通道可能减缓生长,但是通常不能直接杀死癌细胞。因此,许多特异性癌症治疗药物正与传统化疗药物联合用药。这种方法可能是一个极佳的癌症治疗手段,因为特异性癌症药物能攻击癌症的弱点,标准化疗药物能够强有力打击癌症。在这一章节我们会提供一些已被开发或正在开发的只攻击癌症目标的药物。
靶向治疗和传统化疗
Dr. Fadlo Khuri 讨论了靶向治疗和传统化疗的不同。点击观看完整访谈视频。
癌症细胞和正常细胞在内部活动机理中有许多相同之处,而这些机理能够允许细胞进行生存必需的活动。化疗药物针对癌症细胞中生长、分裂必需的过程,例如DNA复制。然而,许多正常细胞,比如消化道内的细胞,同样需要进行DNA复制。简而言之,经化疗药物对癌症细胞有毒性,它们也影响健康细胞。标准化疗药物会产生很多,有时很严重的副作用。而且,这些副作用有时会阻碍病人接受足够剂量。虽然化疗对于很多种癌症都十分有限,研究专家们仍勤奋地合成能够攻击癌症,而保护健康细胞完好的特异性疗法。通过对癌症细胞和正常细胞不同特性的知识积累,靶向疗法诞生了。
癌症细胞最重要的一个特征就是细胞生长基因(癌基因)的变异。这些变异基因所生产的缺陷蛋白是靶向治疗的首选目标。举例而言,一些癌症是由于蛋白质变异,导致一直输送细胞分裂的信息。只抑制这些变异蛋白而不影响正常蛋白的生理活动的药物,只针对癌症细胞而不会对健康细胞造成影响。另一方面,许多癌症是由于阻止细胞生长的基因(肿瘤抑制因子)变异而失活。能够修复这些基因的药物能够修复癌症细胞,理论上来说不会影响正常细胞活动。
激酶抑制剂
激酶的功能
激酶包括很多种直接或间接调节蛋白质活动的酶。所有激酶都能在细胞内的分子,通常是蛋白质,上添加磷酸基团。蛋白质磷酸化,也就是在氨基酸的侧链3上添加磷酸基团,是一个重要的调节活动。 因为磷酸基团带有两个负电荷,添加磷酸基团会改变蛋白质的形状。激酶的磷酸化反应是可逆的,蛋白质可以通过磷酸酶3来脱磷酸基团。磷酸酶和激酶通常协同合作来“开”“关”细胞通信通道。激酶在细胞内通信通道,包括控制细胞生长和细胞分裂的通道中有重要作用。
以下动画描绘了磷酸化的过程。激酶(绿色)有两个结合位点,一个结合ATP(红色),一个结合目标分子(紫色)。在两个位点结合后,磷酸基团(黄色)从ATP转移到目标分子上,改变其结构和功能。点击观看 与William Hahn医生的完整访谈视频,进一步了解激酶的功能。
点击观看 与William Hahn医生的完整访谈视频,进一步了解激酶的功能。
激酶和癌症
在癌症细胞中,细胞生长和细胞周期通道组成型激活(一直激活)。正常情况下的激酶/磷酸酶控制也不再起作用。癌症细胞的一大特征就是能够在缺少外界信号(如生长因子)的情况下进行分裂。在正常情况下,生长因子由其他细胞分泌,然后与该细胞表面的受体结合,刺激细胞分裂。癌症细胞能够在没有生长因子的情况下开启这一通道。这可能是激酶或磷酸酶基因上的变异导致的。举例而言,慢性骨髓性白血病就有这一特征。一个特定的染色体移位(又称费城染色体)会导致一个新的激酶一直处于“开”的状态。因此,这一激酶控制的通道也会一直处于“开”的状态。这会导致癌症细胞的繁殖。
一些癌症疗法试图通过抑制异常开启的激酶来阻止癌症细胞的分裂。以下激酶抑制剂药物被用来治疗癌症。
- 索拉菲尼 (多吉美®)
- 伊马替尼 (格列卫®)
- 吉非替尼 (易瑞沙®)
- 拉帕替尼(Tykerb®)
- 达沙替尼 (Sprycel®)
- 尼洛替尼 (Tasigna®)
- 西罗莫司(Toricel®)
- 厄洛替尼 (特罗凯®)
抗体疗法
抗体是免疫细胞中的B淋巴细胞(简称B细胞)分泌的蛋白质。抗体可以与进入人体的异物(称为抗原)结合,如花粉、细菌等,通过标记来摧毁或移除体内。其目标分子通常是但不限于蛋白质。抗体也可以与其他细胞表面的抗原结合,其中就包括癌症细胞。 4
抗体和抗原之间的结合,如同一把钥匙对一把锁一样,是十分精准的。任何一种B细胞都只能分泌其特定的抗体。人体内有数以百万计的B细胞,因此,有许多不同抗体。事实上,人体可以响应一生中接触的成千,甚至上百万的不同抗原。当一个特定的B细胞遇到特定的抗原,人体会产生大量细胞。其中一些生存时间很长,甚至可以在一开始与抗原结合后生存几年,形成免疫记忆。对于同一抗原的二次响应会导致更快、更强的响应。这类长效记忆是疫苗的基本原理。其他分泌大量抗体的细胞寿命很短。5, 4
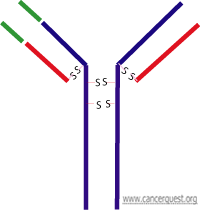
如下图所示,抗体由四个蛋白质分子组成——两个长链和两个短链(紫色)。整个抗体呈Y形,两侧对称。一个抗体可以在每个短臂处和一个目标结合,一共可以和两个目标结合。

任何已知抗原都会导致不同B细胞的激活,产生许多不同种类的抗体,每个抗体针对目标的不同部分。不同抗体的混合被称为多克隆抗体。在实验室中,可以大量生产并提纯一种B细胞产生的某种抗体。这些抗体称为单克隆抗体。目前投入治疗的抗体多为单克隆抗体。5, 4
抗体结构
所有抗体(又称免疫球蛋白,Ig)有共同的特征。每个抗体都有两个小蛋白(轻链)和两个大蛋白(重链)组成。这四个蛋白由半胱氨酸组成的二硫键连接。每个蛋白都有一个恒定区和可变区。恒定区(Fc)有免疫系统能识别的区域。下图中小的红色部分为轻链,蓝色部分为重链。左臂上绿色区域为可变区(右侧未标示,但也含有对称的可变区)。可见二硫键连接整个分子。
抗体类型
抗体可根据恒定区分为五种同型抗体:IgG,IgD,IgA,IgE,和IgM。每个同型抗体都有特定的免疫响应。举例而言,IgG抗体招募有细胞毒性的T细胞,从而摧毁目标细胞。图中显示的是IgG1型抗体。
抗体的可变区识别、结合特定的抗原。不同B细胞分泌的抗体可能识别同一个目标。例如,一个侵入人体的病毒可能在其表面含有不同抗体可识别的区域。甚至同一个蛋白质可由不同抗体识别。
抗体响应
为响应抗原,许多B细胞激活后产生不同抗体,这就是多克隆抗体的来源。这许多抗体的组合能够识别抗原不同部分。
单克隆抗体由同一种B细胞产生,并被作为抗癌药物使用。
癌症治疗中的抗体
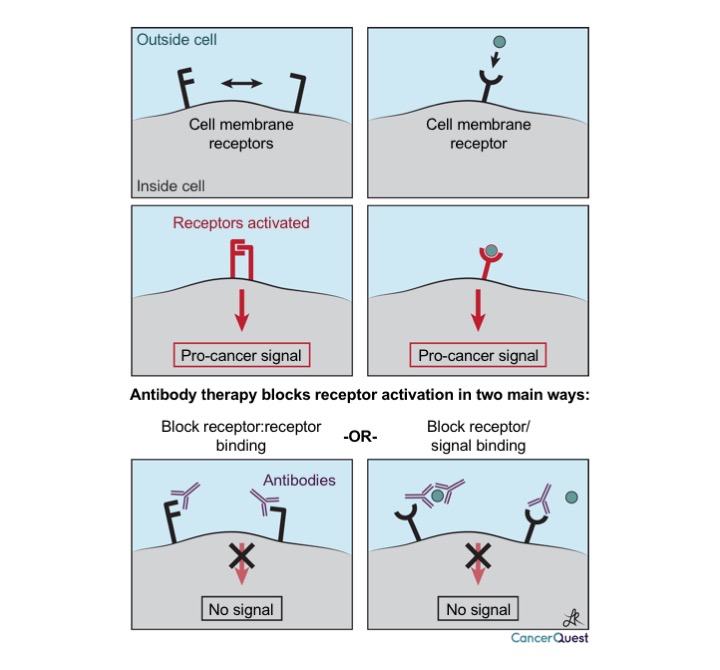
抗体可在以下几方面抑制癌症细胞的生长:
- 受体阻断:这些抗体和细胞生长信号的受体结合阻断信号。
- 抗体激活细胞杀伤:这些抗体与癌症细胞表面的蛋白质结合,抗体本身标记这些细胞,促使免疫系统摧毁它们。这个过程称为抗体依赖性细胞毒性(ADCC)。4
- 免疫毒性:这个方法利用抗体针对对癌症细胞有毒性的分子。这些毒性分子可能是能够抑制细胞活动的蛋白质,也可能是放射性物质,导致癌症细胞DNA损伤,开启细胞凋亡。
下图就是这三类治疗方式。抗体对目标有特异性,可以阻断蛋白质和通信细胞的交流。下图展示了癌症细胞中两种不同的通信方式。第一种是两个蛋白质在癌症细胞表面互相作用,第二种是由细胞外的信息和细胞表面的受体(像天线一样)结合,激发细胞通信。
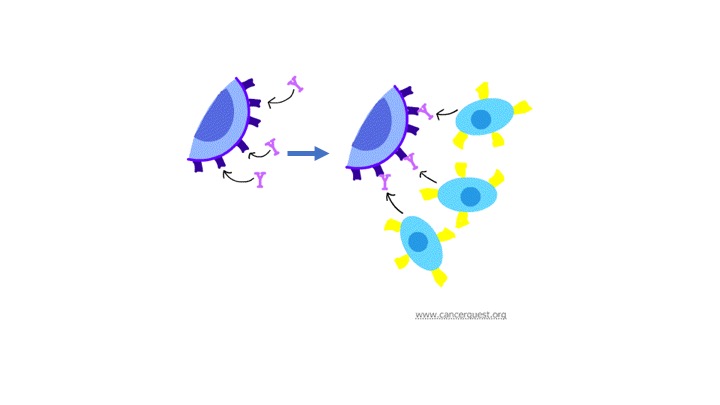
下图展示了抗体如何引发癌症细胞死亡。
抗体(紫色)和癌症细胞(蓝色)结合,之后通过T细胞上的抗体受体(黄色)被免疫细胞识别。这些免疫细胞之后分泌细胞毒素,杀死癌症细胞。
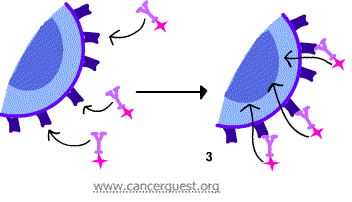
下图所示是第三种方法。抗体细胞自带毒性物质,使癌症细胞内化这些物质,最后导致癌症细胞死亡。
基于抗体的抗癌药物
对于不同癌症有不同的免疫疗法。目前批准治疗癌症的抗体有:
Bexxar® (托西莫)
Campath® (阿伦单抗)
赫赛汀® (曲妥珠单抗)
Mylotarg® (吉妥单抗)
Rituxan® (利妥昔单抗)
泽维宁® (替伊莫单抗)
爱必妥® (西妥昔单抗)
Vectibix® (帕尼单抗)
更多关于抗体治疗的信息,包括商品名,通用名,类型等,参见抗体治疗一览表 。
赫赛汀®详细信息
许多癌症细胞都过度生产有关细胞生长和分裂的蛋白。一个例子就是HER2受体蛋白过度表达,常见于乳腺癌和卵巢癌案例。赫赛汀®可能可以阻止过度表达这类受体的主要/转移癌症细胞的生长。
赫赛汀®是一种单克隆抗体,特别针对HER2蛋白。目前赫赛汀®阻止癌症细胞生长的机理尚不明确,但是证据指出可能有多种机理作用。6 赫赛汀®被认为是通过抑制细胞外受体接受生长信号的方式来阻止癌症细胞生长。下面的动画介绍了正常细胞通信和赫赛汀®的作用。
赫赛汀® 可能可以引发抗体依赖性细胞毒性(ADCC)。其也可能通过其他机理作用。7, 8
血管再生抑制剂
如所有细胞一样,癌症细胞需要有稳定的营养和氧气来源来支撑其生长、分裂的活动。如果缺乏血液供给,肿瘤就不会生长。肿瘤会分泌因子,促进血管的生成,从而获得生存所需的养分和氧气。
血管形成的这一过程称为血管再生。一种抑制方法是阻断肿瘤释放的信号。癌症细胞或是自己分泌因子促进血管再生,或是“诱骗“附近的正常细胞释放这种因子。
血管再生抑制剂的一大好处是它们对于病人的副作用更小。大量血管再生通常见于胚胎发育期,月经周期和伤口愈合。治疗可能干扰这些过程,但是对于正常分裂细胞应该没有影响。
不同于传统的化疗,这种治疗方案并不直接杀死癌症细胞。这些治疗方法的目标通常是由正常细胞控制的正常过程(例如负责形成血管的细胞),而并非肿瘤细胞本身。癌症细胞非常不稳定,但这些药物作用的目标变化的可能性更小。这可能会减小癌症细胞产生抗药性。
目前有一些正在进行的血管再生抑制剂的研究:
- 基质金属蛋白酶抑制剂: 降解细胞周围的细胞外基质是血管形成中的重要过程。在转移一节详细讲到,这一过程同时也是癌症细胞转移到人体其他位置的一个必要过程。 正在生长的血管细胞会分泌基质金属蛋白酶 (MMP), 能够分解细胞外基质,为血管“侵入”这一区域提供空间,并且为癌症细胞提供养分。这一类抑制剂就是抑制这一过程的。
- 内皮细胞抑制剂:目前关于阻止内皮细胞(参与组成血管的一类细胞)的生长及各类活动的药物正在研究中。
- 抑制血管生成激活的抑制剂:这一类血管再生抑制剂通过阻断血管形成的信息通道来抑制血管形成。
目前研发的靶向药物通常会影响多个目标。有时候这是有意的,但也可能是药物无可避免的副作用。
一些美国食药监局批准的抑制血管再生(至少部分抑制)的药物:
贝伐单抗 (阿瓦斯丁®)
西妥昔单抗 (爱必妥®)
索拉非尼(多吉美®)
舒尼替尼(Sutent®)
沙利度胺 (THALOMID®)
蛋白酶抑制剂
蛋白酶是在真核细胞中细胞质,细胞核,内质网,和溶酶体内发现的亚细胞细胞器。9 形如圆柱体,由不同的蛋白质水解(蛋白质分解)的酶组成。其功能包括:
- 分解未组装的蛋白质。
- 分解损坏、误折蛋白。
- 生成免疫系统能识别的多肽。
- 调控能调节细胞周期的调节蛋白的寿命。10
细胞内超过80%的蛋白质由蛋白酶处理.11
蛋白酶对特殊标记了泛素的蛋白质进行分解。分解的信号通常被藏在正确折叠的蛋白质的内部,但是当蛋白质误折或失活后就会暴露在外。当这些信号被暴露时,酶会在目标上连接另一个小的蛋白(泛素,黄色)。之后蛋白酶表面的受体能识别连接了泛素的蛋白,这些蛋白就会被带入蛋白酶并分解。如下图,蛋白质碎片之后会从蛋白酶中释放出。10
蛋白酶调节许多短寿命的调节蛋白——例如调节细胞周期的蛋白——的半衰期。因此,蛋白酶的故障会导致细胞周期调控异常,甚至不受控制的细胞分裂。细胞周期受正信号和负信号的调节。对于任何一个参与其中的蛋白的一点改变都可能倾斜这一平衡,并在癌症的发展和恶化中起重要作用。在正常细胞中,蛋白酶会分解抑制细胞周期的蛋白质,如细胞周期蛋白依赖性激酶抑制剂(CDKI)。 9
对于蛋白质酶功能的抑制会逮住细胞周期停滞和细胞凋亡。癌症细胞更易受此影响,一部分因为它们分裂更快速,另一部分因为许多细胞正常的雕节通道都被破坏了。癌症细胞和正常细胞对于蛋白质酶的抑制的响应不同的机理还不明朗。总而言之,癌症细胞更易受蛋白质酶抑制的影响,可能是治疗特定癌症的有效疗法。9
首个被批准投入临床试验的蛋白酶抑制剂时PS-341(现称MLN-341)。这一药物由千年制药公司研发。这一药物作用于蛋白酶催化位点的一个重要苏氨酸(氨基酸)。尽管这一作用仅限于3个催化位点中的1个,其效用已经足够阻止已连接泛素的蛋白质的降解。12 2003年5月13日,PS-341,现称硼佐替米或万珂™称为全美首个被批准使用的蛋白酶抑制剂,现多用于治疗血液癌症。13
另一个蛋白质酶抑制剂,salinosporin 或称 salinosporamide,由海洋生物体内提取,正处于研究阶段。 14
更多关于硼佐替米的信息:硼佐替米 (万珂®)。
蛋白酶结构功能详解
蛋白质酶的结构与功能有紧密的关系。每个蛋白质酶由一个20S的圆柱状中心和4个环(每个环有7个蛋白质分子)组成。最外侧两个环由α亚基组成,两环完全相同。内侧两环由β亚基组成,完全相同。β亚基有水解的功能。水解通常发生在酶面向内室的一侧。
蛋白质酶中心的两端连接一个(19S)的调节蛋白,可以识别要分解的蛋白质。被标记的蛋白之后被展开,送入内室;这一过程需要能量(ATP)投入。蛋白质被分解为6-9个氨基酸长的多肽,被循环利用。19S的帽和20S的中心组成了人类蛋白酶。
蛋白酶和免疫系统
一些已被分解的蛋白质碎片进入内质网(ER),并被连接到产生免疫反应的蛋白上。这一多肽和免疫蛋白结合体(MHC蛋白)被运送到细胞表面,像旗一样,并导致免疫反应。
分子受体阻断剂
我们的细胞一直监测周围环境中的调节分子的有无。这些信号控制有关细胞分裂,细胞运动甚至细胞死亡的决定。一个检测外环境的方法就是通过位于细胞膜上的分子受体。这些蛋白像细胞天线一样,一旦和一个信号分子介个,受体分子就会向细胞质内或细胞核内搭额分子输送信号,引起适当的反应。一个例子就是HER-2/neu 癌症基因的产品——一种生长因子受体。这一基因在癌症基因一节会详细介绍。15许多不同疾病,包括癌症,都可以追溯到信息通道故障。在癌症中,这些故障会导致不受控制的细胞分裂,最终导致肿瘤的形成。特定信息通道经常在一特定的癌症中有所损伤。设计用来抑制这些特定信息通道的药物可以抑制癌症的生长而不影响正常细胞。这一受体阻断的手段是临床研究的一大热点。15
特定的受体阻滞仍然十分超前,但仍然是医学研究中十分有前景的一大领域。受体阻断剂的一个潜在问题是这些药物的长期作用。这些治疗手段仍然是最近研发,所以副作用仍未明确。通常而言,迄今为止记录的副作用远远低于正常化疗方案。
目前有几例作用于细胞表面受体和蛋白的药物。下表并未穷举所有药物,我们选择了影响不同信息通道的不同药物来展示这一方法的概貌。
已被批准的治疗方案:
蓓萨罗丁 (Targretin®)
地尼白介素(ONTAK®)
其他特异拮抗剂针对卫浴细胞内的激素受体。关于这些阻断剂的信息请见癌症治疗的激素一节。
乳腺癌-选择性雌激素受体修饰剂(SERM)
前列腺癌 - 选择性雄激素受体修饰剂(SARM)
阻断血管形成的药物请见血管再生抑制剂。
组蛋白乙酰转移酶 (HAT) 和组蛋白脱乙酰酶 (HDAC)
除了少数例外(如红细胞),我们的细胞一般都含有基因组的两个拷贝。每个染色体都由一个双链DNA分子组成,其中包含了数以百万计甚至数以亿计的碱基对。这些分子通常很细又极长。每个细胞大概有长约2m(6英尺)的DNA。所有的DNA都必须被压缩到可以在细胞核这一狭小空间内储存的形态。为了达成这一目的,带负电的DNA被压缩,并紧紧缠绕带正电的组蛋白。168个组蛋白(4个不同蛋白质各2个) 形成一个供DNA围绕的中心。组蛋白,与缠绕在它周围的DNA一起,组成了核小体。每个核小体大概有150对碱基,所以一个染色体中大约有上千个核小体结构。如下图所示,核小体由DNA连接,如同被线串起的珠子。核小体可以与非组蛋白结合,进一步压缩成染色质。17
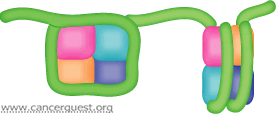
转录因子和目标基因的结合能力一部分上取决于组蛋白的修饰。组蛋白乙酰转移酶(HATs)通过在一些组蛋白上添加短碳链来改变染色质(DNA:蛋白质)的结构。这一修饰改变DNA:组蛋白的相互作用,松开“珠子” ,使得转录因子能够结合。另一组酶,组蛋白脱乙酰酶(HDACs),负责一处组蛋白上的乙酰基团,关闭转录。
当组蛋白脱乙酰之后,组蛋白重新变为带正电荷,使DNA与核小体结合更紧密。脱乙酰反应抑制转录是因为所需的转录因子、调节因子和RNA聚合酶的聚合物无法抵达DNA。 18
HDAC的异常活动已见于几种不同癌症,例如急性早幼粒细胞白血病,急性骨髓性白血病,非霍奇金淋巴癌和几类直肠癌、胃癌。当这些酶异常活动时,他们可以抑制关键基因的转录。这一过程可能是几类癌症的肿瘤形成的关键步骤。 19, 20
组蛋白脱乙酰酶(HDAC) 抑制剂
HDAC抑制剂可以影响几类不同癌症的生长。20这些分子,许多提取自天然来源,已显示出在癌症细胞中抑制繁殖、诱导分化和引起凋亡的能力。组蛋白脱乙酰酶(HDAC)可能在基因表达中有其他作用。研究显示HDAC和直接调节基因表达的蛋白之间由相互作用。研究显示组蛋白脱乙酰酶能够和转录因子直接作用。21 以上的活动显示出HDAC在调节细胞转录的方面的关键作用。
HDAC抑制剂的一个激动人心的特点是在初期研究中显示出低毒性。尽管许多潜在治疗药物仍在细胞培养和动物模型实验阶段,这些药物的实验结果非常有前景;因此,一些已投入临床实验。HDAC抑制剂在实验研究中显示出能影响多种固体和血液癌症,包括神经母细胞瘤,黑色素瘤,白血病(包括急性早幼粒细胞白血病和骨髓性白血病),乳腺癌,前列腺癌,肺癌,子宫癌,和直肠癌。20
HDAC抑制剂可根据其化学结构分类。这些药物的作用机制尚不明朗,但是是目前研究的焦点。一种关电视每个抑制剂抑制特定的一种HDAC,从而对基因表达,细胞周期调控,细胞繁殖,细胞分化和凋亡有其特定的作用。研究员们相信HDAC抑制剂可以引起细胞骨架的改变,进一步帮助抗癌活动。许多抑制剂在低剂量就十分有效,并能够作用于基因组的特定区域,有选择性地改变基因的转录。HDAC抑制剂的作用机制仍需研究,但在实验中显示出其对一些癌症有效、有选择性的治疗药物的潜能。这一类药物可与其他抗癌药物联合使用。 20
2006年,美国食药监局批准了一个HDAC抑制剂:付利诺他(Zolinza®)
还有几类药物正在实验中。22
临床实验阶段的HDAC抑制剂列表 (NCI).
反义药物
在 细胞功能 一节已详细讲到,我们的基因由染色体组成。染色体由DNA长链(核苷酸聚合物)组成。当需要表达特定基因的时候,转录会生成对应的信使RNA(mRNA)。
不同于DNA的双链结构,信使RNA是单链。像DNA分子一样,这些单链RNA可以和互补的核酸链结合。因此,如果另一个与该mRNA的核酸序列完全互补(反义序列)的单链核酸进入细胞,这一序列会和该mRNA结合并灭活mRNA。这样的mRNA无法进入基因翻译而被分解。
反义寡核酸药物是药物研发的新领域。这类科技使研究人员能够通过完全特异性而靶向几乎任何细胞活动。如果一个蛋白质帮助肿瘤细胞生长,那么合适的反义寡核酸能够阻止这一蛋白的形成。因为反义寡核酸具有如此的特异性,其他蛋白质受其影响的可能性很小。这一特异性应该可以减少常见于传统癌症疗法的副作用。23
以下动画展示了反义RNA的功能。动画的第一部分描述了mRNA(紫色)的正常翻译过程。第二部分显示了一个反义RNA(RNA)与mRNA(紫色)结合,阻碍蛋白质生成。
这一灭活的完整机理尚不明确,但是可能与双链RNA在正常细胞中十分罕见这一特性有关。因为每个蛋白质的生产“指令”都是由一个独特的mRNA携带,这些信息可以通过互补序列被单独灭活或“敲除”。23
美国食药监局尚未批准反义癌症药物,但许多临床实验正在测试针对不同癌症类型的不同靶点的药物。24, 25, 26
有关反义药物的临床实验列表 (NCI).
核酶
酶是加快反应进程的有机催化剂。尽管大部分已知酶是蛋白质,一些RNA分子,核酶,也具有催化剂特性。核酶参与许多细胞活动,但在癌症研究领域中, 其最吸引人的是它其切割信使RNA(mRNA)的能力。当mRNA被切割之后,它就无法被翻译成蛋白质。通过靶向定位编码有病理作用的蛋白质的mRNA,核酶能够减缓或者抑制癌症生长。
核酶拥有两个参与mRNA切割的关键区域。一个区域与目标RNA序列结合,另一个负责在目标位点切割。如果一个mRNA的核酸序列已知,可以编辑针对这一mRNA的核酶。人类基因组计划提供了识别癌症特定基因/蛋白质的关键信息,为设计核酶提供许多目标。通过八项定位特定mRNA, 核酶可以对抗特定的癌症时期,包括细胞增殖,抗药性及转移。
下面的动画展示了核酶与mRNA结合并切割mRNA的过程。
一些基因位点包括:
- ras - 一个刺激癌细胞增殖的癌基因。21, 27 更多关于ras的信息: ras
- c-fos - 编码辅助一些基因转录的蛋白 18
- MDR1 - 一种有关对化疗药物抗药性产生的跨膜蛋白。28, 29 更多关于MDR的信息:MDR
- MMP-9 - 一个有关肿瘤转移的酶16
- VEGFR-1 - 一个血管内皮衍生生长因子受体。 Angiozyme® (RPI.4610), 是第一个研发的核酶药物。30 曾被研究用于肾癌,但不再进行临床实验。
美国食药监局还未批准核酶药物。
基于核酶药物治疗的临床实验列表 (NCI).
核酶详解
ANGIOZYME 曾是第一个参与人体实验的合成核酶。通过切割生成VEGF1(血管内皮生长因子)的受体的mRNA,它被设计用于对抗血管形成过程。这一受体的减少会抑制肿瘤内血管形成,从而抑制肿瘤生长。
这一药物曾在几种肿瘤类型中进行临床实验,包括乳腺癌和结肠癌。实验中的药物有有限的显著毒性,低概率的副作用产生。 31但是对于 Angiozyme 的临床反应并不尽如人意。目前此药物不再进行临床实验。
ANGIOZYME 由Sirna 制药 和Chiron 合作开发。目前他们暂停了对于此药物的进一步研发。 32
酶活化剂
酶是人体内加速反应进程的蛋白。酶可以制造或分解细胞生长维护所需的分子。下面的动画展示了一个酶将两个生物分子结合制成一个大分子的过程。
许多化疗药物通过靶向定位关键的酶来作用于癌症。这一类抑制酶的药物的例子有伊利替康 和 拓扑替康;两者都是拓扑异构酶抑制剂。
对于限制细胞生长的酶的激活和补充可以减少肿瘤细胞的分裂。一个例子就是: 门冬酰胺酶(Elspar®)
了解流程:靶向治疗
了解流程是一个测试你对知识了解的教育游戏。游戏规则:
- 将右栏内合适的选项拖曳至左侧并按顺序排列。注意你只需要用六个选项中的五个来完成游戏。
- 完成之后,点击“Check”来检测答案是否正确。
- 对于错误的答案,点击“介绍”来了解关于这一过程的信息。
- 点击“Reset”来重启。
Please visit us on a larger screen to play this game.
- 1 C. E. McCoach G. M. Blumenthal L. Zhang A. Myers S. Tang R. Sridhara P. Keegan R. Pazdur R. C. Doebele D. Kazandjian. Exploratory analysis of the association of depth of response and survival in patients with metastatic non-small cell lung cancer treated with a targeted therapy or immunotherapy. 2017 Aug 2. [ANNALS OF ONCOLOGY]
- 2 Gibbs J. "Mechanism-based target identification and drug discovery in cancer research." Science (2000) 287: 1969-1973 [PUBMED]
- 3ab Becker, Hardin, Kleinsmith. The World of the Cell. San Francisco: Benjamin Cummings, 2003.
- 4abcd Goldsby R, Kindt T, Osborne B. Kuby Immunology. 4th ed. WH Freeman & Company, New York: 2000.
- 5ab Microbiology and Immunology Online. Produced by the University of South Carolina School of Medicine. Accessed August 26, 2010 [http://pathmicro.med.sc.edu/book/immunol-sta.htm]
- 6 Genentech Product Information [http://www.gene.com]
- 7 Albanell J, Arribas J, Baselga J, Codony-Servat J, Molina MA, Rojo F. "Trastuzumab (Herpceptin), a humanized anti-HER2 receptor monoclonal antibody, inhibits basal and activated HER2 ectodomain cleavage in breast cancer cells." Cancer Research (June 2001). 61: 4744-4749. [PUBMED]
- 8 Barnes M. "Response of metastatic breast cancer to trastuzamab." Lancet (2000). 355: 160-161. [PUBMED]
- 9abc Adams J. "Development of the proteosome inhibitor PS-341." The Oncologist (2002). 7: 9-16. [PUBMED]
- 10ab Schwartz AL, Ciechanover A. "The ubiquitin-proteasome pathway and pathogenesis of human diseases." Annu Rev Med (1999). 50:57-74. [PUBMED]
- 11 Geradts J, Ingram CD. "Abnormal expression of cell cycle regulatory proteins in ductal and lobular carcinomas of the breast." Modern Pathology (2000). 13(9): 945-953. [PUBMED]
- 12 Adams J. "Proteosome inhibition as a novel approach to cancer therapy." In Detection and Prevention Online. Millenium Pharmaceuticals, Inc. (2002). [http://cancerprev.org/Meetings/2002/Abstracts/1095/447]
- 13 Einsele H. Bortezomib Recent Results Cancer Res. 2010;184:173-87. [PUBMED]
- 14 Chauhan D, Catley L, Li G, et al. (2005). "A novel orally active proteasome inhibitor induces apoptosis in multiple myeloma cells with mechanisms distinct from Bortezomib". Cancer Cell 8 (5): 407-419 [PUBMED]
- 15ab Downward, J. "The ins and outs of signaling" Nature (June 14, 2001). 411: 759-762. [PUBMED]
- 16ab Hua J and Muschel RJ. "Inhibition of matrix metalloproteinase 9 expression by a ribozyme blocks metastasis in a rat sarcoma model system." Cancer Res (1996). 56: 5279-82. [PUBMED]
- 17 Ribozyme Pharmaceuticals [http://www.rpi.com]
- 18ab Scanlon KJ, et al. "Ribozyme-mediated cleavage of c-fos mRNA reduces gene expression of DNA synthesis enzymes and metallothionein." PNAS (1991). 88 (23): 10591-5. [PUBMED]
- 19 Marks P, Rifkind RA, Richon VM, Breslow R, Miller T, Kelly WK. "Histone deacetylases and cancer: causes and therapies." Nat Rev Cancer (2001). 1(3): 194-202. [PUBMED]
- 20abcd Richon VM, O'Brien JP. "Histone deacetylase inhibitors: a new class of potential therapeutic agents for cancer treatment." Clin Cancer Res (2002). 8(3): 662-4. [PUBMED]
- 21ab Ohta Y, et al. "H-ras ribozyme-mediated alteration of the human melanoma phenotype." Ann NY Acad Sci (1994). 716: 242-53. [PUBMED]
- 22 Lane AA, Chabner BA. Histone deacetylase inhibitors in cancer therapy. J Clin Oncol. 2009 Nov 10;27(32):5459-68. Epub 2009 Oct 13. [PUBMED]
- 23ab Isis Pharmaceuticals [http://www.isip.com]
- 24 Caruso G, Caffo M, Raudino G, Alafaci C, Salpietro FM, Tomasello F. Antisense oligonucleotides as innovative therapeutic strategy in the treatment of high-grade gliomas. Recent Pat CNS Drug Discov. 2010 Jan;5(1):53-69. [PUBMED]
- 25 Cassell A, Grandis JR. Investigational EGFR-targeted therapy in head and neck squamous cell carcinoma. Expert Opin Investig Drugs. 2010 Jun;19(6):709-22. [PUBMED]
- 26 Patel MP, Masood A, Patel PS, Chanan-Khan AA. Targeting the Bcl-2. Curr Opin Oncol. 2009 Nov;21(6):516-23. [PUBMED]
- 27 Wang CH, Tsai LJ, Tsao YP, Hsieh JT, Chien WW, Liao CL, Wang HW, Liu HS, Chen SL. "Recombinant adenovirus encoding H-ras ribozyme induces apoptosis in laryngeal cancer cells through caspase- and mitochondria-dependent pathways." Biochem Biophys Res Commun. 2002 Nov 15;298(5):805-14. [PUBMED]
- 28 Scanlon KJ, et al. "Ribozyme-mediated reversal of the multidrug-resistant phenotype." PNAS (1994). 91(23): 11123-7. [PUBMED]
- 29 Nagata J, Kijima H, Hatanaka H, Asai S, Miyachi H, Abe Y, Yamazaki H, Nakamura M, Watanabe N, Mine T, Kondo T, Scanlon KJ, Ueyama Y. "Reversal of drug resistance using hammerhead ribozymes against multidrug resistance-associated protein and multidrug resistance 1 gene." Int J Oncol. 2002 Nov;21(5):1021-6. [PUBMED]
- 30 Weng DE, Usman N. Angiozyme: a novel angiogenesis inhibitor. Curr Oncol Rep. 2001 Mar;3(2):141-6. [PUBMED]
- 31 Weng DE, Usman N. "Angiozyme: a novel angiogenesis inhibitor." Curr Oncol Rep. 2001 Mar;3(2):141-6. [PUBMED]
- 32 Sirna Therapeutics. "Specialty Programs: Angiozyme." Online. Available. http://www.sirna.com/rnai/specialty.html. Oct. 21, 2004 [http://www.sirna.com/rnai/specialty.html]
